A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o uso do Remdesivir contra a covid-19, sendo o primeiro medicamento antiviral a ter recomendação em bula para pacientes com o novo coronavírus.
Também nesta sexta, a Anvisa concedeu o registro definitivo para a vacina da Universidade de Oxford/AstraZeneca. Dessa forma, a vacina está liberada para ser utilizada na população em geral.
Raphael Sanchez, especialista da gerência de qualidade de medicamentos da Anvisa, afirmou que que, ao contrário das vacinas, o Remdesivir não fez uso da submissão contínua no processo de autorização de uso.
"A submissão se deu em 6 de agosto de 2020, quando tivemos contato com o dossiê completo. Depois da submissão, também tivemos algumas conversas para entender melhor pois é um medicamento desenvolvido com bastante celeridade e muitos aspectos ainda não estão fechados", explicou.
"Na análise da qualidade, nosso principal papel é garantir (...) em que termos o medicamento tem que estar para garantir (...) que ele tenha qualidade e segurança", explicou.
A gente espera que ele seja fornecido com qualidade, eficácia e segurança que são necessários e ajude as pessoas acometidas pela Covid-19."
Ele explicou ainda que o medicamento será vendido em forma de "pó para solução injetável" que deve ser reconstituído no momento da aplicação, terá prazo de validade de 36 meses, e será vendido com o nome comercial de Veklury.
Já Julia Calatrone, da Gerência Geral de Fiscalização e Inspeção da agência, explicou que acadeira de suprimento aprovada para o Brasil envolve 6 unidades de fabricação do Remdesivir, cinco nos Estados Unidos e uma na Irlanda.
"Todas já inspecionados anteriormente pela agência nos últimos anos por fazerem parte da cadeira de suprimentos de outros medicamentos já registrados no Brasil", explicou.

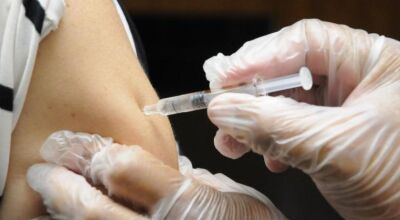
Anvisa aprovou uso do antiviral Remdesivir para tratamento de pacientes com Covid-19
Foto: Ulrich Perrey/Reuters
Indicações de uso do medicamento
O Remdesivir poderá ser utilizado no Brasil em pessoas com idade superior a 12 anos, com pelo menos 40 kg, que estejam com pneumonia e precisem de suplementação de oxigênio.
"É importante destacar que a indicação terapêutica aprovada em bula não se restringe à forma leve, moderada ou grave da doença. Ela está ligada à apresentação da pneumonia com necessidade de suplemento de oxigênio, desde que o paciente não esteja em ventilação mecânica ou extracorporea", disse Renata Lima Soares, gerente de Avaliação de Segurança e Eficácia da Anvisa.
Ela explicou que a aplicação inicial recomendada do medicamento é em dose única, de 200mg, administrado por infusão intravenosa. A partir do segundo dia, a dosagem é reduzida por 100mg. O Remdesivir deve ser usado por, no mínimo, cinco dias e, no máximo, dez dias.
"Chegou-se à conclusão que o Remdesivir exibia uma potente atividade in vitro e in vivo contra o SARS-Cov-2. O rim foi identificado como único órgão alvo de toxicidade, mas nenhuma preocupação maior foi identificada", disse.
"Em termos de cenário regulatório internacional, o medicamento foi aprovado em diversas agências, incluindo a europeia EMA, a americana FDA, a canadense, e diversos outros países", completou.
Quando foi infectado pelo novo coronavírus, no fim de setembro, o ex-presidente dos EUA Donald Trump fez uso do antiviral para se tratar seguindo orientação de sua equipe médica.
Soares disse também que Remdesivir pode prevenir uma progressão da infecção causada pela Covid-19 e que os estudos demonstraram menor tempo de recuperação no grupo que recebeu a medicação.
Recomendação difere da OMS
Questionada pela imprensa, a Anvisa afirmou que o estudo da Organização Mundial da Saúde (OMS) que não recomendou o uso do Remdesivir em pacientes com Covid-19 avaliou mais o perfil de mortalidade, diferindo do perfil analisado pela agência.
“A OMS focou na prevenção de mortes. Os estudos que consideramos válido é se houve uma redução no tempo de hospitalização dos pacientes. Então a gente considerou que é mais uma terapia pro combate da Covid-19”, afirmou Gustavo Mendes, gerente-geral de Medicamentos e Produtos Biológicos da Anvisa.
Esses dados avaliados pela agência indicaram, por exemplo, que o tempo médio de internação de pacientes com suporte de oxigênio – mas não com ventilação invasiva – tratados com Remdesivir diminuiu de 15 para 10 dias em comparação com os que não receberam o antiviral.
“Redução no tempo de hospitalização é um parâmetro válido, principalmente no contexto brasileiro com falta de leitos”, completou Mendes.
Por fim, a Anvisa esclareceu que, no momento, não existem outros pedidos de registro de medicamentos que possam ser usados em pacientes com Covid-19 – só pedido de estudos.
Em novembro, o atualizar suas orientações contínuas sobre os medicamentos contra Covid-19, a OMS desaconselhou o uso Remdesivir para tratar pacientes hospitalizados, independentemente da gravidade da doença.
De acordo com a atualização, publicada na revista médica BMJ, as evidências não sugeriam que o Remdesivir afetava o risco de morte por Covid-19 ou necessidade de ventilação mecânica, entre outros resultados importantes.
Além disso, em entrevista à CNN a vice-diretora geral da OMS, Mariângela Simão, explicou que a orientação era baseada em diversos estudos que, no total, somaram mais de 7 mil pacientes avaliados que usuaram o remédio contra o novo coronavírus.
"Esses estudos mostraram que o Remdesivir não adiciona nada em termos de mortalidade ou progressão da doença para pacientes leves e, além de tudo, ele é injetável e bastante caro. A OMS recomenda mais estudos e pesquisas sobre o Remdesivir. Com o conhecimento atual, ele não altera a progressão da doença e não evita mortes", disse a médica sanitarista, na época.
Leia Também
 VÍTIMA IDENTIFICADA
VÍTIMA IDENTIFICADA
TRAGÉDIA: Identificada a jovem de 25 anos que morreu em grave acidente
 Saúde
Saúde
Identifique Vírus Respiratórios com Agilidade e Segurança no Laboratório Bonito
 Saúde
Saúde
Boletim Epidemiológico: MS registra 2.891 casos confirmados de dengue
 Saúde
Saúde
Bonito realiza a Campanha de vacinação contra a influenza no Grupo Conviver Idosos
 Saúde
Saúde
Dengue recua em MS, mas avanço da Chikungunya acende alerta de que cuidados precisam ser mantidos
 Novo Boletim
Novo Boletim
Bonito tem 16 novos casos de dengue
 Saúde
Saúde
Dores nas Articulações? Saiba se é Chikungunya com um Teste Simples!
 Saúde
Saúde
Idosa de 80 anos é mais uma vítima da gripe em MS
 Saúde
Saúde
Bonito divulga boletim e confirma 9 novos casos de dengue na cidade
 Saúde
Saúde

